GST親和層析介質(GST Agarose)是專門設計用于純化谷胱甘肽S-轉移酶(GST)融合蛋白、其它谷胱甘肽轉移酶以及與谷胱甘肽有親和作用蛋白的分離介質,一步分離就可得到高純度的GST融合目標蛋白,純化條件溫和,可以保證蛋白的活性。
本產品是**設計合成的GST瓊脂糖凝膠,具有優良的物理和化學穩定性,使用壽命長,操作方便,批次重復性好,易于放大,是研發與生產的理想選擇。 二、 性能參數

三、 適用范圍
分離谷胱甘肽S-轉移酶(GST)融合蛋白、其它谷胱甘肽轉移酶以及與谷胱甘肽有親和作用的蛋白。 四、 操作說明 1. 緩沖液配制
緩沖液A(平衡緩沖液):10mM Na2HPO4,1.8mM KH2PO4,140mM NaCl,2.7mM KCl,調節pH值**8.0。 緩沖液B(洗脫緩沖液):10mM Glutathione(還原型),50mM Tris-HCl,調節pH值**8.0。因Glutathione易氧 化,需現用現配。
(注:各種溶液配制完畢后,**好進行脫氣處理,0.45 μm濾膜過濾備用)。 2. 樣品預處理:按每克濕重菌體/2~5ml平衡緩沖液的比例充分懸浮離心收集的菌體;600w功率,每循環超聲3s,冷卻3s,循環99×3次,破碎菌體;4℃、15000rpm離心15m,收集上清液,或用0.45μm濾膜過濾。 3. 裝柱: 聚苯乙烯層析柱
1) 將層析柱固定在鐵架臺或層析架上,封閉層析柱下端出口,向柱內充入純水,排開層析柱內空氣,先將墊片完全浸沒于水面下方,在保持水平的狀態下,小心推向底部,避免墊片下方滯留氣泡。
2) 打開層析柱下端出口,排出柱中純水;在液面低**距墊片1~1.5cm高度時封閉下端出口,用移液槍按需要量吸取介質,或用玻璃棒緊靠柱子內壁引流,將介質加入到層析柱中;靜置30min,讓介質自然沉降。
3) 從上端管口將另一墊片緩慢推**介質沉降平面,使介質表面保持水平狀態,注意避免墊片與介質接觸面滯留氣泡(如對實驗結果要求不嚴,也可不放入上墊片,以提高流速)。
4) 在使用一段時間后,如果層析柱流速減慢,可先用小鑷子沿邊緣將墊片推翻,夾出墊片,倒出介質,清洗或更換新的墊片后,按2)、3)所述 玻璃層析柱
1) 將層析柱洗凈后垂直固定到鐵架臺上;向柱中加入蒸餾水,排開柱子中的空氣,在蒸餾水排盡以前,關閉柱子出口,在柱內保留5~8cm高度的蒸餾水。
2) 先將介質混勻,用移液槍按需要量吸取介質,或用玻璃棒緊靠柱子內壁引流,將介質加入到層析柱中;靜置30min,讓介質自然沉降。
3) 從上端管口將轉換桿出液端緩慢推**介質沉降平面,使介質表面保持水平狀態,注意避免轉換桿與介質接觸面間滯留氣泡。
4) 在使用一段時間后,如果流速減慢,可先卸下上轉換桿,將介質倒出,再取出下轉換接頭中濾網,清洗或更換后重新裝柱。 4. 過柱:
1) 用10倍介質體積緩沖液A過柱,平衡介質;
2) 上樣;
3) 用5~10倍介質體積緩沖液A過柱,洗去層析柱中剩余上樣液并重新平衡介質; 4) 用5~10倍介質體積緩沖液B洗脫,收集洗脫液; 5) 用5~10倍介質體積緩沖液A重新平衡介質。
注:純化過程流速不宜過快,對于1ml介質,流速保持在0.5ml/min為宜。 5. 介質清洗
如果在使用一段時間后,介質因表面沉積過多雜質導致蛋白結合能力下降,需對介質進行清洗。步驟如下: 1) 沉淀或變性物質的清洗:
用2倍介質體積6 M鹽酸胍清洗,然后用5倍介質體積緩沖液A平衡介質。 2) 疏水締合物質的清洗:
用3~4倍介質體積70%乙醇 (或2倍介質體積去垢劑,如 1% Triton™ X-100) 清洗介質;然后用5倍介質體積緩沖液A平衡介質。 6. 介質再生
每次層析前,為達到**佳純化效果,需對介質進行再生,步驟如下:
1) 2倍介質體積高pH緩沖液(0.1M Tris-HCl, 0.5M NaCl, pH8.5)和低pH緩沖液(0.1M sodium acetate, 0.5M NaCl, pH4.5)交替洗脫三次。
2) 10倍介質體積緩沖液A平衡介質。 7. SDS-PAGE檢測:
1) 不同濃度SDS-PAGE分離膠分離范圍
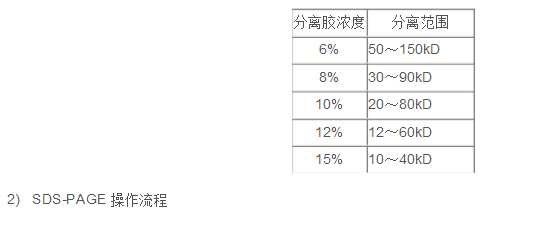
.
A. 每個膠孔**適蛋白上樣量為5~10μg。
B. 將含5~10μg蛋白的樣品溶液與loading buffer混勻,90℃孵育5min,取出后5000rpm離心1 min。 C. 上樣,15mA、30mA恒流或80V、120V恒壓電泳。 8.介質保存
4℃~8℃條件下,介質可長期保存于20%乙醇中。 五、 GST Agarose分離GST融合蛋白實例
層析介質:GST 1ml;對照GST介質(*際**品牌)1ml
樣品:表達可溶性GST-tag融合thioredoxin的大腸桿菌BL21裂解液 #p#分頁標題#e#
結合緩沖液:10mM Na2HPO4,1.8mM KH2PO4,140mM NaCl,2.7mM KCl,pH 8.0 洗脫緩沖液:10 mM Glutathione(還原型), 50 mM Tris-HCl, pH8.0 流速:GST 1ml,0.5ml/min;對照GST介質1ml,0.5ml/min 實驗結果:
色譜分析結果見圖1,色譜各組分的SDS-PAGE結果見圖2。 圖1 GST Agarose分離GST融合蛋白色譜圖
1.低分子量Marker;2.上樣液; 3.GST-流穿液;4.GST-洗脫液; 5.對照-流穿液;6.對照-洗脫液
1 2 3 4 5 6 圖2 純化后SDS-PAGE圖
六、GST親和層析介質使用注意事項
1. GST融合蛋白與還原型谷胱甘肽的結合比較緩慢,為獲得**大結合量,需要保證足夠的作用時間,因而在上樣時要維持較低流速。在樣品中加入5~10mM DTT可以增加介質對目標蛋白的吸附。對于按常規步驟操作吸附效果不好的樣品,可以先把介質和樣品混合,輕輕振搖2~4h,再裝柱,用平衡緩沖液進行重新平衡、洗脫等操作。
2. 不同的GST融合蛋白取得**佳純化效果所需還原型谷胱甘肽濃度、洗脫體積和洗脫時間可能有所不同。必要時需對流穿液、洗脫液進行SDS-PAGE以及Western雜交分析,以確定**佳純化條件。
3.GST融合蛋白以包涵體形式存在時不能與介質結合,必須先進行變性、復性、透析處理后才能用介質進行純化。純化效果取決于復性效率。 4.純化后出現雜帶的常見原因 1) 目標蛋白斷裂或酶解
解決方案:向緩沖液A和緩沖液B中加入1mM PMSF抑制蛋白酶活性,或0.1%TritonX-100或0.1%Tween-20等穩定劑。
2) GST融合蛋白不完全表達
GST融合蛋白有時候只表達到GST部分就終止,GST標簽蛋白連同完全表達的融合蛋白均能與介質結合并被洗脫下來,因而洗脫液中出現26KD左右的雜帶。
解決方案:嘗試用不同濃度的還原型谷胱甘肽洗脫;優化表達條件,降低GST融合蛋白不完全表達量;改變外源基因在載體中插入的酶切位點,重新構建表達載體;在不改變外源基因兩端酶切位點的情況下,更換通用載體。 5. 如后續實驗需要除去洗脫液中還原型谷胱甘肽,可采用超濾或透析的方法。 七、GST標簽切除
GST標簽可用位點專一的蛋白酶如凝血酶或Xa因子從融合蛋白中切除。蛋白酶解后,再用GST親和層析方法去除GST標簽,目標蛋白存在于流出液中。一般情況下,與切除GST標簽后得到的外源蛋白相比,凝血酶用量極小,如果后續實驗要求不嚴格,不需進一步除去與外源蛋白共存與洗脫液中的凝血酶。如需除去凝血酶,則可將樣品用pH7~8的緩沖液溶解,然后直接過1ml的苯甲脒瓊脂糖凝膠或者肝素瓊脂糖凝膠吸附凝血酶。

 .
.